

Abbreviation (ISO4): Chinese Journal of Alzheimer's Disease and Related Disorders
Editor in chief: Jun WANG
Chinese Journal of Alzheimer's Disease and Related Disorders >
The clinical analysis of 18 cases with early on-set Alzheimer's disease
Received date: 2021-02-01
Revised date: 2021-03-05
Online published: 2021-06-25
Objective: To explore the clinical characteristics of early on-set Alzheimer's disease (AD), improving the understanding of the diagnosis and treatment of the disease. Methods: This was a case-retrospective study on the data of clinical manifestations, neuropsychology, dynamic EEG and structural MRI of 18 early on-set AD patients who were proved with cerebral spinal fluid AD biomarkers. Results: The average age of 18 patients(6 males,12 females) with AD was 55.4 years old, and the average course of the disease was 5.6 years.17 patients suffered memory loss as initiate symptom, and 9 patients had family histories of dementia. The average score of MMSE was 14.3, and there existed 12 patients with moderate and severe dementia. Among 13 patients who accomplished gene whole-exon sequencing, we found 3 cases with PSEN1 mutations, 4 cases with SORL1 mutations, 1 case with ABCD7. At the same time, the carrying frequency of APOE gene ε2, ε3, ε4 in 18 patients was 1/36, 27/36 and 9/36, respectively. All 13 cases who accepted dynamic EEG testing showed abnormal EEGs with epileptiform discharge. The hippocampus atrophy of 8 patients was not significant. Conclusion: The clinical characteristics of the early on-set AD were hidden onset but developed fast. At the time of treatment, it has often been developed into severe dementia, with decline memory as initiate symptom and most patients have family history of dementia. Epilepsy discharge of EGG were detected more commonly in these patients, whose carrying rates of AD causing genes and AD risk genes were also higher than normal ones. And some cases had less hippocampus atrophy.
XU Chun-yan , QIU Guo-zhen , GUO Qi-wen , WU Kai-yu , CHEN Chun-chun , LI Ming-kun , MENG Xue-ya , ZHU Fei-qi . The clinical analysis of 18 cases with early on-set Alzheimer's disease[J]. Chinese Journal of Alzheimer's Disease and Related Disorders, 2021 , 4(2) : 110 -115 . DOI: 10.3969/j.issn.2096-5516.2021.02.004
表1 18例早发型AD患者脑脊液检测阿尔茨海默病生物标志物汇总Tab.1 Summary of cerebral spinal fluid AD biomarkers of 18 patients with early-onset AD |
| 病例 | Aβ42(pg/ml)(<550pg/ml提示淀粉样病变) | Aβ42/Aβ40比值(≤0.1提示AD可能) | 磷酸化Tau蛋白(181)(pg/ml)(>61pg/ml提示神经纤维缠结) | 总Tau蛋白(pg/ml)(>452pg/ml提示神经细胞死亡) |
|---|---|---|---|---|
| 1 | 377.74 | 0.05 | 120.29 | 528.67 |
| 2 | 298.61 | 0.06 | 193.00 | 949.92 |
| 3 | 336.81 | 0.04 | 193.00 | 708.87 |
| 4 | 495.66 | 0.02 | 152.94 | 1017.40 |
| 5 | 431.31 | 0.09 | 80.65 | 392.78 |
| 6 | 511.33 | 0.05 | 193.00 | 1131.20 |
| 7 | 405.00 | 0.06 | 103.00 | 880.00 |
| 8 | 264.29 | 0.05 | 145.21 | 303.64 |
| 9 | 522.06 | 0.01 | 145.89 | 717.43 |
| 10 | 443.07 | 0.02 | 90.85 | 619.40 |
| 11 | 451.95 | 0.07 | 141.66 | 772.82 |
| 12 | 381.99 | 0.07 | 80.85 | 602.74 |
| 13 | 375.86 | 0.05 | 105.94 | 620.49 |
| 14 | 377.33 | 0.06 | 133.99 | 514.07 |
| 15 | 299.64 | 0.06 | 181.02 | 1223.13 |
| 16 | 338.62 | 0.03 | 93.00 | 493.50 |
| 17 | 172.15 | 0.02 | 68.03 | 376.08 |
| 18 | 447.87 | 0.09 | 60.86 | 462.98 |
表2 18例早发型AD患者临床特点汇总Tab.2 Summary of clinical characteristics of 18 patients with early-onset AD |
| 病例 | 性别 | 发病年龄 | 评估年龄 | MMSE | APOE 基因型 | 突变基因 | 家族史 | 动态脑电图 | MTA③视觉评分 |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 男 | 39 | 49 | 27 | E3/E4型 | ABCA7基因 | 有 | 可见癫痫样放电。 | 0 |
| 2 | 女 | 41 | 51 | 15 | E2/E3型 | PSEN1基因 | 无 | 可见癫痫样放电。 | 0 |
| 3 | 男 | 42 | 44 | 8 | E3/E3型 | SORL1基因 | 无 | 1.大量慢波活动2.可见癫痫样放电 | 1 |
| 4 | 女 | 49 | 52 | 15 | E3/E3型 | SORL1基因 | 无 | 一② | 0 |
| 5 | 女 | 49 | 52 | 28 | E3/E3型 | 未发现① | 无 | 局灶尖波、三相波,睡眠周期不完整。 | 0 |
| 6 | 女 | 54 | 61 | 7 | E3/E3型 | 未发现 | 无 | 一 | 3 |
| 7 | 女 | 55 | 63 | 2 | E3/E3型 | PSEN1基因 | 有 | 可见癫痫样放电。 | 2 |
| 8 | 男 | 57 | 67 | 10 | E3/E3型 | 一 | 无 | 一 | 3 |
| 9 | 男 | 58 | 60 | 26 | E3/E4型 | PSEN1基因 | 有 | 1.大量慢波活动2.可见癫痫样放电 | 1 |
| 10 | 男 | 59 | 62 | 13 | E3/E4型 | 一 | 有 | 一 | 2 |
| 11 | 女 | 60 | 70 | 7 | E3/E3型 | SORL1基因 | 有 | 1.大量慢波活动2.阵发性δ波活动3.少量尖波 | 3 |
| 12 | 女 | 61 | 64 | 4 | E3/E3型 | SORL1基因 | 有 | 1.θ-δ慢波活动2.广泛阵发尖波、棘波 | 3 |
| 13 | 女 | 61 | 65 | 7 | E3/E4型 | 未发现 | 有 | 一 | 3 |
| 14 | 女 | 62 | 65 | 20 | E3/E4型 | 一 | 无 | 1.大量慢波活动2.可见癫痫样放电 | 1 |
| 15 | 女 | 62 | 68 | 24 | E3/E4型 | 未发现 | 有 | 慢波活动增多。 | 1 |
| 16 | 女 | 62 | 67 | 23 | E3/E4型 | 一 | 有 | β活动增多,α节律未见。 | 2 |
| 17 | 男 | 63 | 66 | 11 | E3/E3型 | A2M基因 | 无 | 一 | 2 |
| 18 | 女 | 63 | 71 | 8 | E3/E4型 | 一 | 无 | 一 | 2 |
Note: ①:Whole-exome sequencing of the gene did not detect pathogenic/suspected pathogenic variants that were clearly related to the clinical phenotype;②:The symbol “-” means that the check has not been done.;③:MTA visual score (medial temporal lobe atrophy rating scale score) [i]: Grade 0: no atrophy; Grade 1: only the widening of choroidal fissure; Grade 2: also accompanied by enlargement of the temporal horn of the lateral ventricle; Grade 3: moderate reduction in hippocampus volume (decreased height); Grade 4: severe reduction in hippocampus volume. |
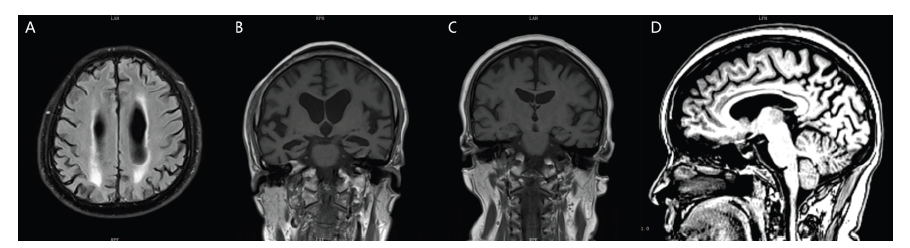
图A 病例8患者头颅MRI T2 FLAIR像脑白质损害融合成大的病灶;图B 病例8患者头颅MRI T1像冠状位见海马重度萎缩,MTA评分4级;图C 病例4患者头颅MRI T1像冠状位见海马正常,MTA评分0级;图D 病例4患者头颅MRI T1像失状位见后扣带沟、顶枕沟增宽,扣带回后方和楔前叶萎缩。Fig.A T2-weighted Flair MRI images showing white matter lesions fused into large lesions in Case 8;Fig. B T1-weighted MRI images showing severe hippocampus atrophy in coronal position, and MTA score is 4 in Case 8;Fig.C T1-weighted MRI images showing normal hippocampus in coronal position, and MTA score is 0 in Case 4;Fig.D T1-weighted MRI images showing the posterior cingulate groove, parieto-occipital groove widening, cingulate back posterior and anterior cuneiform atrophy in sagittal position in Case 4. |
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
王刚. 痴呆与认知障碍神经心理测评量表手册[M]. 北京: 科学出版社, 39.
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
/
| 〈 |
|
〉 |